Условие задачи:
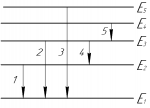 На рисунке представлена схема энергетических уровней атома водорода. Какой цифрой обозначен переход с излучением фотона, имеющего максимальный импульс?
На рисунке представлена схема энергетических уровней атома водорода. Какой цифрой обозначен переход с излучением фотона, имеющего максимальный импульс?
Задача №11.4.17 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Решение задачи:
Запишем формулу длины волны де Бройля \(\lambda\):
\[\lambda = \frac{h}{p}\]
В этой формуле \(h\) — это постоянная Планка, равная 6,62·10-34 Дж·с.
Откуда импульс фотона равен:
\[p = \frac{h}{\lambda}\;\;\;\;(1)\]
Длину волны \(\lambda\) можно выразить через скорость света \(c\), которая равна 3·108 м/с, и частоту колебаний излучения \(\nu\) по следующей формуле:
\[\lambda = \frac{c}{\nu}\;\;\;\;(2)\]
Подставим выражение (2) в формулу (1), тогда получим:
\[p = \frac{{h\nu }}{c}\]
Видно, что в числителе дроби мы получили не что иное, как энергию фотона \(E\), поэтому:
\[p = \frac{E}{c}\]
Согласно второму постулату Бора энергия излученного фотона равна разности энергий стационарных состояний электрона на орбитах n и k, то есть:
\[E = {E_n} — {E_k}\]
Поэтому:
\[p = \frac{{{E_n} — {E_k}}}{c}\]
Так как в задаче нужно найти максимальный импульс, то нам нужно найти на рисунке переход электрона, который сопровождался излучением фотона максимальной энергии (т.е. изменение энергии электрона было максимальным). Учитывая, что чем больше расстояние между уровнями на рисунке, тем больше была энергия излученного фотона, искомый переход электрона — 3.
Ответ: 3.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
11.4.16 На рисунке представлена схема энергетических уровней атома водорода. Какой цифрой
11.4.18 В каких случаях наблюдается спектр поглощения газа?
11.4.19 От какого из перечисленных ниже источников света наблюдается линейчатый спектр излучения?