Как известно, любое вещество в зависимости от внешних условий может находиться в твердом, жидком или газообразном состоянии.
Если давление мало, а температура велика, вещество обычно существует в виде газа. При низкой температуре и высоком давлении все вещества превращаются в твердые тела. При каких-то промежуточных значениях параметров существует жидкость. Схематически это изображено на рисунке 1. Осталось провести границы между областями различных состояний — и мы получим так называемую диаграмму состояния вещества в \(p — T\) координатах. Припомним несколько известных фактов, которые помогут нам в этом деле.
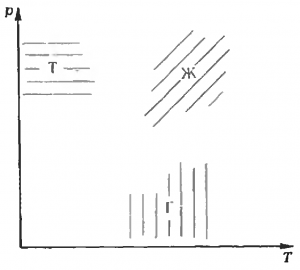
- Давление насыщенных паров растет с ростом температуры; соответственно, температура кипения повышается с ростом давления. Значит, граница жидкость — газ (Ж — Г) идет слева — снизу вправо—наверх.
- Температура плавления слабо зависит от давления — граница твердое состояние — жидкость (Т — Ж) идет почти вертикально.
- Существует особая точка — критическая (\(T_{кр}\), \(p_{кр}\)). При приближении к ней по границе Ж — Г свойства жидкости и газа (в первую очередь — плотности) отличаются все меньше и меньше; в критической точке отличия исчезают. Граница Ж — Г в этой точке кончается.
- Для всех веществ (исключение — гелий) имеется тройная точка — такая совокупность параметров (\(T_{тр}\), \(p_{тр}\)), при которой сосуществуют все три фазы (жидкая, твердая и газообразная). Если \(T < T_{тр}\), \(p < p_{тр}\), то жидкое состояние невозможно, возможны только твердое и газообразное состояния. Следовательно, существует граница твердое состояние — газ (Т — Г). А так как при низких температурах, далеких от критической (\(T \ll {T_{кр}}\)). различие между жидким и твердым состояниями гораздо меньше, чем между ними и газом, поведение границы Т — Г похоже на поведение границы Ж — Г.
Итак, вид диаграммы состояния должен быть примерно таким, как на рисунке 2. Обратите внимание: граница Т — Ж проведена в трех вариантах. Обычный вариант — 1 — температура плавления растет с ростом давления. Но для некоторых веществ, например, висмута, отдельных сортов чугуна, \(T_{пл}\) с ростом давления падает — вариант 2. Для воды \(T_{пл}\) падает до давлений порядка 2·108 Па (2000 атм), а затем начинает расти — вариант 3.

Качественно зависимость температуры фазового перехода (так называют переход вещества из одного состояния — твердого, жидкого или газообразного — в другое) от давления можно понять, опираясь на один из наиболее общих законов природы — принцип Ле Шателье — Брауна). Несколько упрощенно его можно сформулировать следующим образом: «Всякое внешнее воздействие вызывает в системе изменения, уменьшающие эффект этого воздействия».
Так, если насыщенные пары находятся в равновесии с жидкостью, при уменьшении объема, занимаемого системой, давление паров начнет повышаться. Плотность жидкости больше плотности паров. Если часть паров сконденсируется, плотность, а значит, и давление остающихся паров, уменьшится. Эффект внешнего воздействия частично (а если температура поддерживается постоянной, то и полностью) скомпенсируется. Следовательно, немедленно начнется этот компенсирующий процесс — конденсация паров. Чтобы воспрепятствовать конденсации, то есть чтобы всё-таки повысить давление паров, очевидно, надо повысить температуру системы. Таким образом, опираясь (кроме принципа Ле Шателье — Брауна) только на тот факт, что плотность жидкости больше плотности пара, мы пришли к выводу, что более высокому давлению насыщенных паров отвечает более высокая температура.
Чаще всего нас интересует переход жидкость — газ: им мы в основном и будем заниматься.
Обсудим некоторые особенности поведения насыщенного пара. Заметим, в частности, что плотность и давление (иногда несколько старомодно называемое упругостью) насыщенных паров не связаны прямой пропорциональностью.
3адача 1
Приготовление пищи в кастрюле-скороварке идет при температуре \(t_1 = 120^\circ \) C. При такой температуре давление насыщенных водяных паров \(p_1=2\) атм. Во сколько раз плотность пара при этом выше, чем над поверхностью кипящей воды в открытой кастрюле?
В открытой кастрюле вода кипит под давлением \(p_0=1\) атм при температуре \(t_0 = 100^\circ \) C. Из уравнения Менделеева — Клапейрона \(pV = \frac{m}{\mu }RT\) получим выражение для плотности:
\(\rho = \frac{m}{V} = \frac{{\mu p}}{{RT}}\).
Для отношения плотностей имеем:
\(\frac{{{\rho _1}}}{{{\rho _0}}} = \frac{{{p_1}}}{{{p_0}}} \cdot \frac{{{T_0}}}{{{T_1}}} = \frac{{2 \cdot 373}}{{1 \cdot 393}} \approx 1,9\).
Результат понятен: давление должно подняться в 2 раза, но немного выросла температура, значит (это ясно и из формулы \(p = nkT\)) плотность увеличилась меньше, чем вдвое.
Диаграмму состояния мы строили для случая, когда система состоит только из того вещества, состояние которого мы анализируем. Как влияет на состояние наличие посторонних веществ? Чтобы разобраться в этом, решим следующую задачу.
Задача 2
В сосуд объема \(V=22,4\) литра при нормальном давлении воздуха и температуре \(t_0 = 0^\circ \) C налили 18 г воды. Затем сосуд закрыли герметичной крышкой и нагрели до температуры \(t_1 = 100^\circ \) C. Определить давление в сосуде.
К сожалению, нередко можно услышать от школьников два разных, но одинаково неправильных ответа.
- В сосуде давление воздуха \(p_0=1\) атм, да, при нагревании до температуры \(T_1\), оно возрастет до величины \(p_1 = p_0 \frac{T_1}{T_0} = 1 \cdot \frac{373}{273} = 1,3 \) атм. Это больше давления насыщенных паров воды при 100° C; значит, вода испаряться не будет, и общее давление в сосуде будет равно \(p=p_1=1,3\) атм.
- 100° C — температура кипения воды. Значит, вся вода в сосуде испарится; давление образовавшегося пара (в количестве 1 моль — ведь воды было 18 г) нетрудно рассчитать (при \(T_0=273\) К 1 моль в объеме 22,4 л создает давление \(p_0=1\) атм, а при \(T_1=373\) К давление пара будет \({p_{п1}} \approx 1,3\) атм); давление воздуха в сосуде возрастет при нагревании до \({p_{в1}} \approx 1,3\) атм; общее давление станет равным \({p_1} = {p_{п1}} + {p_{в1}} \approx 2,6\) атм.
Авторы первого ответа забывают, что жидкость должна находиться в равновесии со своим паром; это означает, что при \(t_1 = 100^\circ \) C вода будет испаряться, пока давление ее паров не достигнет 1 атм.
Неправилен, понятно, и второй ответ, так как давление паров воды при 100° C не может подняться выше 1 атм.
Итак, в сосуде давление воздуха будет \({p_{в1}} \approx 1,3\) атм, давление водяных паров — \({p_{п1}} = 1\) атм (мы убедились, что масса воды достаточна для создания такого давления), и суммарное давление в сосуде будет всего \({p_1} = {p_{п1}} + {p_{в1}} = 2,3\) атм.
Кстати, кипеть вода при этом не будет. Ведь кипение — это процесс парообразования не только на поверхности жидкости, но и во всем ее объеме. Если температура такова, что соответствующее ей давление насыщенных паров равно суммарному внешнему давлению, то образующиеся внутри жидкости пузырьки пара не схлопываются внешним давлением; дальнейшее испарение внутрь пузырьков увеличивает их объем, пузырьки всплывают, на поверхности лопаются — жидкость кипит.
Подчеркнем еще раз: испарение происходит всегда, когда давление паров над поверхностью жидкости меньше давления насыщенных паров при данной температуре; кипение происходит лишь в том случае, когда суммарное давление (и внутри жидкости) не превосходит давления насыщенных паров при данной температуре.
Между прочим, на Земле полно воды; а относительная влажность, равная 100%, то есть насыщение воздуха парами воды, встречается редко. Почему при избытке воды не вся атмосфера насыщена водяными парами? Может быть, достаточное количество воды просто не успело испариться? Давайте оценим скорость испарения воды.
Задача 3
Оцените количество воды, испаряющейся при комнатной температуре с единицы поверхности в открытом стакане (а также в реке, в ручейке, в океане). Давление насыщенных паров воды при температуре \(T = 300\) К равно \(p_н = 3,5\) кПа.
Когда вода находится в равновесии со своим насыщенным паром, то она, строго говоря, испаряется. Более того, скорость испарения не зависит от того, есть ли над поверхностью воды пар. Она определяется только тем, какое количество молекул воды имеет скорость, достаточную, чтобы покинуть жидкость (и подходящее направление скорости). Просто точно такое же количество молекул пара попадает в жидкость — скорость испарения равна скорости конденсации, существует динамическое равновесие. А подсчитать количество конденсирующегося пара не так уж трудно.
Число молекул пара, попадающих за единицу времени (1 с) на единичную площадку (1 м2) поверхности воды, равно
\[z = \frac{{n\overline {\left| {{\upsilon _x}} \right|} }}{2} = \frac{{{p_н}}}{{2kT}}\sqrt {\frac{{RT}}{M}} \,\,\,\,\left( {\frac{1}{{{м^2с}}}} \right)\]
(так как расчет приближенный, мы не учитываем различия между средним по модулю значением \({\upsilon _x}\) (\({\overline {\left| {{\upsilon _x}} \right|} }\)) и средним квадратичным значением \({\upsilon _x}\) \(\sqrt {\overline {\upsilon _x^2} } \)). Масса же пара, конденсирующегося на единице площади поверхности за единицу времени, равна, очевидно,
\[m = z\frac{M}{{{N_А}}} = \frac{{{p_н}}}{2}\sqrt {\frac{M}{{RT}}} \,\,\,\,\left( {\frac{кг}{{{м^2}с}}} \right)\]
(\(N_А\) — число Авогадро).
Как мы договорились, такая масса воды испаряется независимо от влажности воздуха, то есть независимо от содержания водяных паров в воздухе (что характеризуется значением \(n\)). Если восполнение испаряющейся воды не происходит (влажность очень маленькая), то именно такое количество воды испарится, уйдет с единицы поверхности за секунду. Рассчитаем понижение уровня воды за секунду:
\[h = \frac{{{p_н}}}{{2\rho }}\sqrt {\frac{M}{{RT}}} = \frac{{3,5 \cdot {{10}^3}}}{{2 \cdot {{10}^3}}}\sqrt {\frac{{18 \cdot {{10}^{ — 3}}}}{{8,3 \cdot 300}}} = 4,7 \cdot {10^{ — 3}}\;м/с = 4,7\;мм/с\]
На первый взгляд ничего страшного в этом результате нет. Но вспомним, что средняя глубина океанов около 4 км; значит, время их полного испарения порядка 106 с, а это немногим более 10 суток!
В чем же дело? Почему океаны существуют?
Есть несколько обстоятельств, мешающих их исчезновению.
Начнем с менее важных. Во-первых, относительная влажность не равна нулю. Но если даже мы примем ее равной 90%, это лишь на порядок понизит скорость испарения. Во-вторых, не все молекулы пара, ударяющиеся о поверхность воды, остаются в жидкости — некоторые отскакивают, отражаются. Следовательно, мы завысили скорость конденсации, а значит, и равную ей скорость испарения. Пусть «прилипает» десятая часть молекул (число, близкое к реальному, но уже заниженное). Накинем еще порядок. Мы продлили жизнь океанов до 100 дней, до 1001 дня. Для Шехерезады (и мировой литературы) это эпоха, но для океана с его миллиардолетней историей три года — миг.
Но вернемся к нашему стакану. Даже с введенной нами поправкой в 100 раз вода из полного стакана должна испариться полностью меньше, чем за полчаса. Цифра явно нереальная. В действительности над поверхностью воды быстро образуется слой насыщенных паров, точнее — слой воздуха с относительной влажностью 100%. И только до образования этого слоя уровень воды понижается со скоростью 4,7 мм/с. Как только слой образовался, скорость конденсации становится почти равной скорости испарения, и дальнейшее понижение уровня воды определяется весьма медленным процессом диффузии паров от поверхности жидкости в окружающее пространство.
Впрочем, в судьбе океанов главную роль играют не эти факторы, замедляющие испарение; океанам хватило бы времени для полного испарения. Дело в том, что мы рассматривали равновесные или почти равновесные (квазиравновесные) системы. А земная атмосфера — система существенно неравновесная. Теплый влажный воздух поднимается в холодные слои атмосферы, там вода конденсируется, а на пути к поверхности Земли капли не успевают испариться. Океанские воды пополняются, круговорот воды в природе продолжается.
Упражнения
1. Твердый галлий плавает в своем расплаве. Как зависит температура плавления галлия от давления?
2. Что вы можете сказать о свойствах льда при давлениях выше 2000 атм?
3. Как известно, при жарке пищи кипит находящаяся в ней вода, а не масло, на котором жарится еда. Давление насыщенных паров масла при 100° C равно \(p_м=1\) мм рт. ст., молярная масса масла \(M_м=80 \cdot 10^{-3}\) кг/моль. Во сколько раз отличаются плотности паров воды и масла под крышкой сковороды?
4. Какое максимальное количество воды может полностью испариться в условиях задачи 2?
Источник: Журнал «Квант», №12 1981 г. Автор: В. Белонучкин.