Условие задачи:
Один моль одноатомного газа совершает цикл, состоящий из двух изохор и двух изобар. При этом максимальное давление в 2 раза больше минимального, а максимальный объем в 3 раза больше минимального. Определите коэффициент полезного действия цикла.
Задача №5.5.45 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
\(\nu=1\) моль, \(p_2=2p_1\), \(V_2=3V_1\), \(\eta-?\)
Решение задачи:
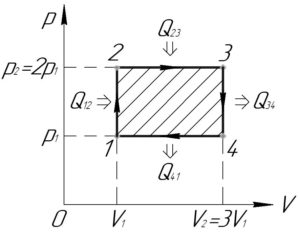 Изобразим цикл, совершаемый над газом, в координатах p-V (смотрите схему).
Изобразим цикл, совершаемый над газом, в координатах p-V (смотрите схему).
КПД цикла \(\eta\) определяют по формуле:
\[\eta = \frac{A}{{{Q_н}}}\;\;\;\;(1)\]
Работа газа в цикле \(A\) равна площади цикла в координатах p-V, при этом если цикл обходится по часовой стрелке (как у нас), то работа цикла положительна.
\[A = \left( {{p_2} — {p_1}} \right)\left( {{V_2} — {V_1}} \right)\]
Так как по условию \(p_2=2p_1\) и \(V_2=3V_1\), то:
\[A = \left( {2{p_1} — {p_1}} \right)\left( {3{V_1} — {V_1}} \right) = 2{p_1}{V_1}\;\;\;\;(2)\]
Отлично! Теперь, чтобы найти количество теплоты \(Q_н\), нужно определить все процессы в цикле, в которых тепло подводилось к газу. Для начала запишем первый закон термодинамики, мы к нему будем постоянно обращаться:
\[Q = \Delta U + A\;\;\;\;(3)\]
Изменение внутренней энергии одноатомного идеального газа \(\Delta U\) определяют по формуле:
\[\Delta U = \frac{3}{2}\nu R\Delta T\;\;\;\;(4)\]
Работу газа \(A\) можно определить следующим образом:
\[A = p\Delta V\;\;\;\;(5)\]
Также запишем уравнение Клапейрона-Менделеева для состояния газа в точках 1-4. В уравнениях сразу учтём, что \(p_2=2p_1\) и \(V_2=3V_1\).
\[\left\{ \begin{gathered}
{p_1}{V_1} = \nu R{T_1} \;\;\;\;(6)\hfill \\
2{p_1}{V_1} = \nu R{T_2} \;\;\;\;(7)\hfill \\
2{p_1} \cdot 3{V_1} = \nu R{T_3} \;\;\;\;(8)\hfill \\
{p_1} \cdot 3{V_1} = \nu R{T_4} \hfill \\
\end{gathered} \right.\]
Рассмотрим процесс 1-2, который является изохорным (\(V=const\)), значит работа газа \(A_{12}\) в этом процессе равна нулю (так как \(\Delta V_{12}=0\)). Поэтому количество теплоты \(Q_{12}\) по формуле (3) равно:
\[{Q_{12}} = \Delta {U_{12}}\]
Тогда согласно формуле (4), имеем:
\[{Q_{12}} = \frac{3}{2}\nu R\Delta {T_{12}}\;\;\;\;(9)\]
Так как в этом изохорном процессе давление увеличивается, значит по закону Шарля температура также растёт (\(\Delta T_{12}>0\)). Поэтому из формулы (9) следует, что тепло в процессе 1-2 подводилось (\(Q_{12}>0\)). Отнимем из уравнения (7) уравнение (6):
\[{p_1}{V_1} = \nu R\left( {{T_2} — {T_1}} \right)\]
\[{p_1}{V_1} = \nu R\Delta {T_{12}}\]
Тогда формула (9) примет такой вид:
\[{Q_{12}} = \frac{3}{2}{p_1}{V_1}\;\;\;\;(10)\]
Если провести аналогичные рассуждения для изохорного процесса 3-4, то Вы выясните, что \(Q_{34}<0\), то есть тепло в этом процессе отводилось от газа.
Также рассмотрим изобарный процесс 2-3 (\(p=const\)). Количество теплоты \(Q_{12}\) согласно формуле (3) равно:
\[{Q_{23}} = \Delta {U_{23}} + {A_{23}}\;\;\;\;(11)\]
Изменение внутренней энергии \(\Delta U_{23}\) по формуле (4) равно:
\[\Delta {U_{23}} = \frac{3}{2}\nu R\Delta {T_{23}}\;\;\;\;(12)\]
Работа газа \(A_{23}\) согласно формуле (5) равна:
\[{A_{23}} = {p_2} \cdot \left( {{V_2} — {V_1}} \right) = {p_2}{V_2} — {p_2}{V_1}\]
Так как в условии сказано, что \(p_2=2p_1\) и \(V_2=3V_1\), то:
\[{A_{23}} = 2{p_1} \cdot 3{V_1} — 2{p_1}{V_1}\]
Учитывая уравнения (7) и (8), имеем:
\[{A_{23}} = \nu R{T_3} — \nu R{T_2}\]
\[{A_{23}} = \nu R\Delta {T_{23}}\;\;\;\;(13)\]
Подставив выражения (12) и (13) в формулу (11), получим:
\[{Q_{23}} = \frac{3}{2}\nu R\Delta {T_{23}} + \nu R\Delta {T_{23}}\]
\[{Q_{23}} = \frac{5}{2}\nu R\Delta {T_{23}}\;\;\;\;(14)\]
Так как в изобарном процессе 2-3 объем увеличивался, значит по закону Гей-Люссака его температура росла (\(\Delta T_{23}>0\)). Поэтому из формулы (14) следует, что тепло в процессе 2-3 подводилось (\(Q_{23}>0\)). Отнимем из уравнения (8) уравнение (7):
\[4{p_1}{V_1} = \nu R\left( {{T_3} — {T_2}} \right)\]
\[4{p_1}{V_1} = \nu R\Delta {T_{23}}\]
Тогда формула (14) примет такой вид:
\[{Q_{23}} = \frac{5}{2} \cdot 4{p_1}{V_1}\]
\[{Q_{23}} = 10{p_1}{V_1}\;\;\;\;(15)\]
Проведя аналогичные рассуждения для изобарного процесса 4-1, Вы выясните, что \(Q_{41}<0\), то есть тепло в этом процессе отводилось от газа.
В ходе наших рассуждений мы выяснили, что к газу теплота подводится только в процессах 1-2 и 2-3, то есть количество теплоты \(Q_н\) равно:
\[{Q_н} = {Q_{12}} + {Q_{23}}\]
Примем во внимание полученные равенства (10) и (15), тогда:
\[{Q_н} = \frac{3}{2}{p_1}{V_1} + 10{p_1}{V_1}\]
\[{Q_н} = \frac{{23}}{2}{p_1}{V_1}\;\;\;\;(16)\]
Тогда согласно формуле (1) коэффициент полезного действия цикла \(\eta\), учитывая выражения (2) и (16), равен:
\[\eta = \frac{{2{p_1}{V_1}}}{{\frac{{23}}{2}{p_1}{V_1}}} = \frac{4}{{23}} = 0,174\]
Ответ: 0,174.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
5.5.44 Тепловая машина с максимально возможным КПД имеет в качестве нагревателя
5.5.46 Над одним молем идеального газа совершают цикл, показанный на рисунке
5.5.47 В некотором процессе внутренняя энергия газа уменьшилась на 300 Дж, а газ
не правильно изначально
Откуда 3/2 в уравнение Менделеева клайперона?
С некоторой массой одноатомного газа совершают замкнутый цикл, состоящий из двух изохорных и двух изобарных процессов. При изохорном нагревании давление увеличивается в 3 раза, а при изобарном нагревании объём увеличивается на 50 %. Чему равен КПД цикла?
Помогите решить задачу!
когда A=(2p1—p1)(3V1—V1) должно быть =p1 2V1 а не 2p1V1 ?
Какая разница где стоит эта двойка? Произведение же от этого не поменяется